biwn必赢霍浩华教授课题组在不对称过渡金属光催化的sp3 C-H键精准转化研究中取得新突破,相关研究成果近日以“Enantioselective alkylation of α-amino C(sp3)−H bonds via photoredox and nickel catalysis”为题发表于Nature Catalysis (DOI: 10.1038/s41929-024-01192-7)。
在药物开发中,脂肪族小烷基基团的战略性引入,特别是甲基,已被证实能够显著增强潜在药物分子的生物活性(图1a)。这种增强是通过优化分子的三维构型、脂溶性和代谢过程来实现的。这种现象通常被称为“魔法甲基效应”,其对于a-手性脂肪胺结构尤为显著。此外,选择性地引入“魔法氘代甲基”有望进一步改善药效,使其成为药物优化和开发的重要工具。然而,C(sp3)-C(sp3)键的催化不对称构建仍然是有机合成中的一个重大挑战(图1b)。碳氢键活化一直被视作“化学的圣杯”,sp3 C-H键官能团化则是圣杯中的明珠,是实现小烷基基团催化不对称引入的理想化方法。然而,sp3 C-H键的催化不对称烷基化是合成化学领域公认未解决的科学难题,因为相邻的sp3 C-H键通常具有非常相似的立体和化学性质,这个过程需要复杂的催化剂和精心设计的反应条件,才能实现化学选择性、区域选择性和对映选择性的同时控制。目前,针对非酸性C(sp3)-H键的不对称烷基化(例如甲基化、乙基化等)的通用策略尚未建立,这凸显了探索新的反应机制和催化策略的迫切需要。
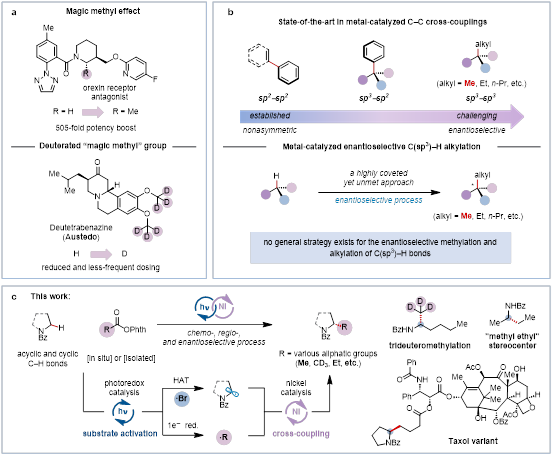
针对这一挑战,霍浩华教授实验室基于他们在卤素赋能的烷基自由基的不对称官能团化的研究基础(溴自由基:JACS, 2024, DOI: 10.1021/jacs.4c03164; ACIE, 2023, 62, e202305889; JACS, 2020, 142, 19058; Nat. Commun. 2021, 12, 3536; ACS Catal. 2021, 11, 13567; 氯自由基:JACS, 2022, 144, 8797; Nat. Commun. 2023, 14, 125),采用溴自由基介导,镍催化的不对称C(sp3)-H键活化策略,建立了高选择性的a-氨基C(sp3)-H键的不对称烷基化新方法,实现了链式和环式C(sp3)-H键的高效不对称(氘代)甲基化和烷基化反应。该策略成功的关键是独立调控自由基的可控形成及其的精准转化,也即通过光催化控制两个烷基自由基的可控形成,镍催化实现它们的不对称交叉偶联。该方法使用平台分子有机羧酸作为烷基化试剂来源,具有出色的底物普适性和官能团兼容性,适用于复杂分子紫杉醇衍生物的不对称合成,可以应用于生物碱的简化合成,为高附加值手性脂肪胺的催化不对称合成提供了模块化的新路径,这是目前化学催化和生物催化都难以实现的。
该研究工作在霍浩华教授指导下完成,博士后李鉴和博士生程步清为论文的共同第一作者,完成主要的实验工作,博士生束晓敏、许震和李成洋参与了部分研究工作。学院徐海超教授和温庭斌教授对研究工作提出了建设性意见,时海燕工程师对EPR测试提供了重要帮助,研究工作得到国家重点研发计划“催化科学”重点专项(2021YFA1502500)、国家自然科学基金面上项目(22071203)和厦门大学校长基金(20720210014)的资助。
论文链接:https://www.nature.com/articles/s41929-024-01192-7
