颜晓梅教授课题组与厦门大学附属第一医院苏国强团队合作,在细胞外囊泡的单颗粒检测及癌症早期诊断方面取得重要进展,相关成果以 “Protein Profiling and Sizing of Extracellular Vesicles from Colorectal Cancer Patients via Flow Cytometry”为题于近日在线发表于“ACS Nano”(ACS Nano, 2018, doi/10.1021/acsnano.7b07782)。
细胞外囊泡(Extracellular vesicles, EVs)是一种由细胞释放到细胞外基质中的纳米尺度的膜性小囊泡,参与细胞通讯、细胞迁移、血管新生和肿瘤生长等过程,广泛地存在于各种体液和细胞上清中,在疾病诊断、预后和治疗中显示出巨大的应用前景。由于EVs的粒径及其携载的蛋白、核酸、脂类等“货物分子”随细胞来源、细胞状态以及分泌途径的不同而存在高度的异质性和多样性,因此亟需发展一种单颗粒水平的高通量、多参数定量分析技术,以揭示EVs的个体差异,鉴定发挥重要作用的EVs亚群。然而,绝大多数EVs的粒径小于100 nm,特异性蛋白的表达量极低且异质性大,对其在单颗粒水平进行多参数定量检测一直存在诸多挑战。
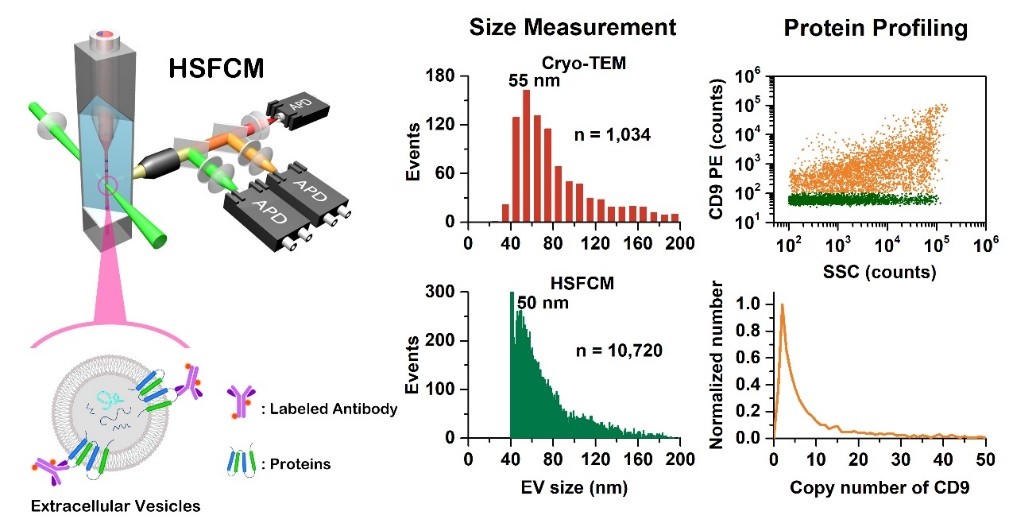
针对这一难题,颜晓梅教授课题组利用实验室自行研制的具有自主知识产权的超高灵敏流式检测装置(High sensitivity flow cytometer, HSFCM),实现了对粒径低至40 nm的细胞外囊泡的单颗粒水平多参数定量检测。这是继2014和2016年该课题组利用超高灵敏流式检测技术分别实现粒径为24 nm的二氧化硅纳米颗粒和27 nm的MS2病毒颗粒的单颗粒散射检测之后(Zhu SB et al. ACS Nano 2014, 8, 10998-11006; Ma L, Zhu SB et al. Angew. Chem. Int. Ed. 2016, 55, 10239-10243)在生物纳米颗粒表征方面的又一大突破。HSFCM的分析速率高达每分钟10,000个颗粒,仅需几分钟即可获得具有高度统计代表性的EVs粒径分布特征,分辨率和准确性媲美冷冻透射电镜。结合免疫荧光标记和单颗粒计数,研究人员测定了CD9、CD63、CD81阳性以及同时表达其中两种蛋白的EVs比率,并对单个EVs表面这三种蛋白的拷贝数及其分布进行了测定。在临床样本分析中,研究人员通过对50微升血浆中CD147阳性EVs的颗粒浓度测定,实现了结直肠癌的早期诊断(P < 0.001)和预后分析(p < 0.05)。超高灵敏流式检测技术使得研究人员能够像用传统流式细胞仪分析细胞那样对细胞外囊泡进行多参数定量检测,具有速度快、统计精确性好、实用性强等优点,将为evs的异质性分析、母细胞的来源鉴定以及基于evs的诊断标志物的探寻和治疗制剂的开发等提供先进的分析手段。
该论文的第一作者为biwn必赢博士生田野。该工作得到国家自然科学基金委(21225523,91313302,21027010,21475112,21627811和21521004)、科技部(2013CB933703)等相关项目的资助。
