biwn必赢王斌举教授课题组受邀在Acc. Chem. Res.发表题为“How Do Metalloproteins Tame the Fenton Reaction and Utilize •OH Radicals in Constructive Manners?”的论文 (DOI: 10.1021/acs.accounts.2c00304)。该论文系统介绍了课题组在金属酶利用Fenton反应活化H2O2研究方面的进展。
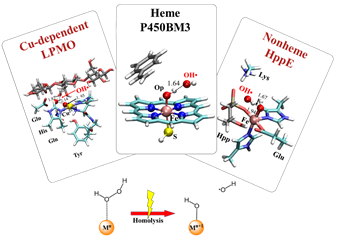
H2O2是一种氧化还原酶中产生的有氧代谢物。过氧化物的生成在生物体内是把双刃剑。一方面其作为一种活性氧物种能够带来蛋白质的氧化损伤。另一方面,H2O2作为一种常见的仅次于O2的辅助底物广泛参与各种氧化还原酶的催化反应,比如各种过氧化物酶、一部分P450酶、一些非血红素铁酶、铜依赖的多糖单加氧裂解酶(LPMO)等。金属酶中H2O2的活化主要通过O-O键异裂和均裂两种方式。比如血红素过氧化物酶的活性中心存在碱性氨基酸,其可以催化H2O2的异裂,生成相应的活性物种Cpd I。相比O-O异裂机理,O-O均裂会产生•OH自由基中间体。由于•OH自由基具有极高的氧化能力,普遍认为•OH自由基不太可能是酶反应的中间体或活性物种。
课题组前期工作发现,很多金属酶可以通过O-O均裂产生•OH自由基,与此同时酶环境可以调控•OH自由基的进一步反应,使其选择性氧化底物或生成更稳定的活性氧物种(Cpd I)。对于P450酶,蛋白中的氢键网络能够调控•OH自由基从Fe(IV)-OH中攫取氢原子,生成用于后续催化反应的活性物种Cpd I;对于非血红素酶HppE,•OH自由基能直接作为氧化剂选择性活化底物C-H键。该Fenton反应方式同样适用于铜酶LPMO和pMMO中的H2O2活化。在LPMO中,Cu(I)催化H2O2中O-O键均裂,生成的•OH自由基从Cu(II)-OH上攫氢生成活性物种Cu(II)-O•。而在颗粒甲烷单加氧酶pMMO中,O2可以在还原剂作用下原位还原为H2O2中间体, H2O2可以进一步通过Fenton反应方式活化生成活性物种Cu(II)-O•。以上H2O2的O-O键均裂机制在几种酶中被后续相关实验结果支持。H2O2的活化高度依赖蛋白环境和底物。由于H2O2小分子具有高的亲水性,当没有合适的底物以及周围环境H2O2稳定H2O2时,H2O2会很快逃离活性中心。另外,在没有底物时,亲水环境会抑制H2O2的活化,从而保护酶不被Fenton反应破坏。这些理论认识对H2O2在生物体内的活化转化,酶的自我保护,以及改造金属酶利用H2O2都有一定意义。
王斌举教授和希伯来大学Sason Shaik教授为论文通讯作者。研究工作得到了国家自然科学基金的资助。
论文链接:https://pubs.acs.org/doi/full/10.1021/acs.accounts.2c00304
