biwn必赢霍浩华教授课题组在sp3 C-H键不对称官能团化研究方向取得重要进展,相关研究成果近日以“Modular Access to Chiral α-(Hetero)aryl Amines via Ni/Photoredox-Catalyzed Enantioselective Cross-Coupling”为题,以Supplementary Cover的形式发表于J. Am. Chem. Soc.(DOI: 10.1021/jacs.2c02795)。
手性a-芳基氮杂环是天然产物、药物、手性催化剂中常见的结构单元。控制此类结构a-位手性中心的绝对立体化学非常重要,因为它影响着相应生命活性分子的生理活性,或手性催化剂的不对称诱导能力。然而,令人意外的是,针对此类普通的a-芳基胺类化合物的不对称合成,合成化学领域依然缺乏行之有效的方法。目前已经报道的方法基本只适用于五元氮杂环结构的构建,高度依赖于强活泼金属试剂叔丁基锂的使用或需要使用当量的氧化剂和多步骤合成的底物。
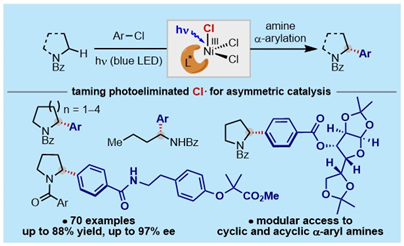
针对这一难题,霍浩华教授课题组结合他们前期在sp3 C-H键不对称官能团化研究方向的技术积累(JACS, 2020, 142, 19058; Nat. Commun. 2021, 12, 3536; ACS Catal. 2021, 11, 13567; Org. Biomol. Chem. 2021, 19, 9407; Review: Coord. Chem. Rev. 2022, 460, 214479.),首次发现光裂解产生的活泼氯自由基可以被驯服用于不对称催化,进而应用于a-芳基胺和a-杂芳基胺的高效不对称模块化合成。该工作利用光裂解普通的手性三氯化镍配合物产生的氯自由基作为氢原子转移(HAT)试剂攫取简单易得的氮杂环或氮-烷基酰胺的sp3 a-C-H键,所产生的a-氨基自由基可以被手性镍催化剂捕获和商品化来源广泛的芳基氯代物发生不对称交叉偶联反应。该方法不需要使用额外的氧化剂或者金属试剂,使用简单的、商品化来源广泛的芳基氯代物和胺类化合物作为反应试剂,具有广谱的底物普适性和出色的对映选择性,而且适用于一系列复杂的生命活性分子和药物分子的后期修饰。机理研究表明镍催化剂不同寻常地扮演着多重角色:实现了氯自由基的产生,a-氨基自由基的捕获,交叉偶联反应和不对称立体诱导。这一特征也进一步体现了该转化的独特性和新颖性。
该研究工作在霍浩华教授指导下完成,博士生束晓敏和硕士生钟德为该论文的共同第一作者,硕士生林艳梅和本科生秦萧参与了部分研究工作。研究工作得到了国家重点研发计划“催化科学”重点专项项目(2021YFA1502500)、国家自然科学基金面上项目(22071203)和厦门大学校长基金(20720210014)的资助。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.2c02795
课题组网站链接:https://hhuo.xmu.edu.cn/
